Ao se desenvolver novos medicamentos uma etapa é crucial: a Pesquisa Clínica. Por isso, em maio é comemorado o Mês Internacional da Pesquisa Clínica.
O objetivo é conscientizar a população sobre a importância dos ensaios clínicos, para desenvolvimento de novas tecnologias, dispositivos e medicamentos para a área da saúde.
O assunto teve destaque mundial diante do desafio de combater a Covid-19, quando a comunidade científica internacional se uniu em busca de soluções.
Outro adversário que enfrentaram foram fake News, em relação à qualidade e segurança do processo devido à rapidez dos resultados.
Confira também o especial A Vacina Chegou!
“Medicina baseada em evidências é uma das principais respostas para a melhoria da saúde mundial e transformar vidas”, explica Waleuska Spiess, Head de Operações Clínicas da Roche Farma do Brasil.
“Devemos dedicar esforços e investimentos na condução de trabalhos e na formação de pesquisadores e cientistas”, completa a executiva.
O que é exatamente a pesquisa clínica?
É o resultado de um longo e dedicado processo em que cientistas testam novas descobertas para os avanços da medicina.
Por meio de uma “investigação” são verificadas novas medicações ou mesmo valida medicamentos já utilizados para cuidar de uma doença.
Dessa forma, médicos e cientistas encontram novos rumos para a detecção e o controle de enfermidades.
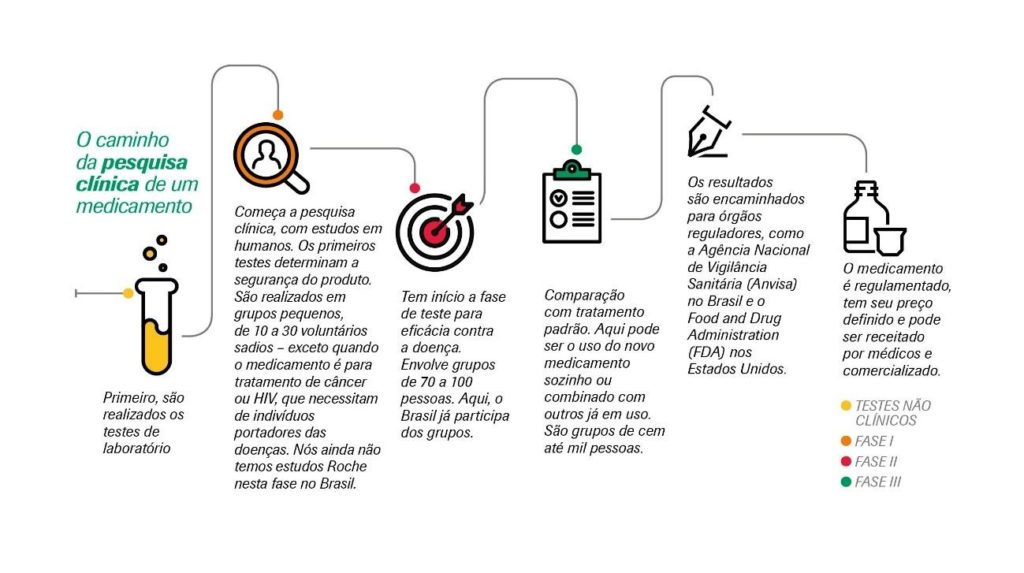
Qual o caminho da pesquisa clínica de um medicamento?
Geralmente, milhares de moléculas são testadas até ser identificada uma com bom potencial para tratar algum problema de saúde.
Depois que isso acontece, começa um longo processo de pesquisa até ela se tornar um medicamento aprovado.
Esse procedimento se divide em pesquisa pré-clínica, que é feita em organismo vivos, e pesquisa clínica, que tem várias fases e é realizada utilizando pessoas voluntárias.
A pandemia acelerou as pesquisas clínicas para o desenvolvimento de vacinas e medicamentos para Covid-19. O que mudou?
A Anvisa autorizou o uso temporário e emergencial de algumas vacinas e medicamentos para combate à Covid-19.
Existe também uma dedicação em tempo integra do corpo técnico dos órgãos brasileiros para avaliar com urgência os pedidos.
Entretanto, para serem aprovados, continuam sendo necessários seguir todos os protocolos solicitados e as condições de qualidade, eficácia e segurança.
É possível confiar nos novos lançamentos da indústria farmacêutica?
Sim. Isso é possível graças a dedicação de diversos cientistas e pesquisadores que já estudavam componentes que tinham relação com a doença.
Dessa forma, buscaram soluções por meio de testes em elementos ou medicamentos já existentes.
Além disso, o aporte e investimentos mundiais em prol das pesquisas e inovações frente aos desafios impostos pelo vírus foram significativos.
Todas as conclusões são altamente seguras e atestadas.
Como ficam os brasileiros nesse cenário?
A pandemia de Covid-19 representa um grande desafio científico e de saúde pública.
A necessidade por conhecimento sobre os mecanismos de transmissão, prevenção e opções terapêuticas vem crescendo cada vez mais.
A pressão para encontrar as respostas para essas dúvidas explica a alta demanda por estudos clínicos.
Essa pandemia trouxe agilidade para aprovação regulatória de pesquisas clínicas para o Brasil – tornando o nosso país atrativo e competitivo comparado a outras nações.
Outra vantagem que nós temos é a diversidade da população.
Somos um país multirracial e com um número significativo de pessoas, o que aumenta nossa capacidade de servir à pesquisa clínica.
Quem pode participar de uma pesquisa clínica?
Os critérios de inclusão ou exclusão, definidos no projeto de pesquisa, definirão quem pode participar.
Eles diferem de um estudo para o outro e são seguidos com rigor para segurança e qualidade dos dados que serão usados para futuramente beneficiar a sociedade.
É assinado algum documento? O participante pode desistir?
O candidato deve assinar o Termo de Consentimento Livre e Esclarecido antes de iniciar a pesquisa.
Esse documento traz todas as informações do processo, incluindo riscos, benefícios e possíveis desconfortos que possam ocorrer.
O participante tem direito ao anonimato e deve ter liberdade para decidir se quer ou não participar do estudo.
Mesmo com o termo assinado, o voluntário está livre para mudar de ideia e se retirar do projeto, a qualquer momento, sem nenhum tipo de prejuízo.
Existem riscos para quem participa?
Como todo estudo, existe certo risco, pois ainda serão testados alguns aspectos do procedimento.
Antes de se voluntariar para um estudo é importante tirar todas as dúvidas e entender os possíveis efeitos colaterais decorrentes dos tratamentos, assim poderá identificar eventos adversos inesperados que podem ocorrer.
Por que é importante participar de pesquisas clínicas?
Ser voluntário de pesquisas clínicas é uma oportunidade de contribuir para que pessoas tenham mais qualidade de vida.
Também é a possibilidade de ser um dos primeiros, caso tenha a doença estudada.
Por meio desses ensaios, novos ou melhores medicamentos e tecnologias são integrados no hall de tratamentos ou processos e podem salvar vidas.